נזק לשריר הלב המוביל לפגיעה בתפקודו עד כדי אי ספיקת לב נגרם משורה של מחלות, השכיחה מבין כולן היא אוטם לבבי חריף (Acute Myocardial Infarction -AMI). במחלה זו חסימה של עורק המספק דם לשריר הלב גורמת להרס סיבי שריר לב ובהמשך להחלפתם ברקמה צלקתית. למרות השיפור בהבנת המחלה ובדרכים לטפל בה חולים רבים עדיין מפתחים אי ספיקת לב הנחשבת לאחד מגורמי המוות השכיחים ביותר וסיבה נפוצה לאשפוזים חוזרים.
הטיפול הנפוץ באוטם לבבי חריף כולל פתיחת העורק הכלילי החסום על מנת לחדש את אספקת החמצן ללב מהר ככל הניתן. עם זאת, בשבוע הראשון לאחר חידוש אספקת הדם, מתפתח בדרך כלל נזק כתוצאה מתהליך דלקתי סוער. בדלקת נוצרת הסננה מסיבית של תאי מערכת החיסון לאזור האוטם, בעיקר של תאים בולעניים המכונים מקרופאגים. המקרופאגים במקרים רבים מחסלים ובולעים את תאי שריר לב (קרדיומיוציטים) בעלי פוטנציאל שיקומי. כתוצאה מכך, ההחלמה מהאוטם נפגעת ומותירה את המטופלים עם תפקוד לב ירוד וסיכון מוגבר לפתח אי ספיקת לב. אין כיום טיפול יעיל להפחתת התגובה הדלקתית המתרחשת בשבוע הראשון לאחר אוטם שריר הלב.
במחקר שבוצע במעבדת המחקר הקרדיו-וסקולרית בראשות פרופ' גד קרן וד"ר מיכל אנטין-מר נבחן כיצד ניתן לבצע מודולציה של פעילות המקרופאגים בימים שלאחר חידוש אספקת הדם כדי לאפשר החלמה טובה יותר מהאוטם. המעבדה מצאה שחלבון מפתח האחראי לפעילות הדלקתית המוגברת של המקרופאגים באזור האוטם הוא חלבון תעלת יונים בשם Transient Receptor Potential Vaniloid 2 – TRPV2. החלבון מתבטא ביתר על המקרופאגים המתקבצים באזור האוטם כ-3 ימים לאחר האירוע הלבבי (תמונה 1). הביטוי המוגבר קשור לתפקוד לב ירוד ולתמותה מוגברת של עכברים לאחר אוטם.
בהמשך לממצאים חבר צוות המעבדה למרכז בלווטניק לפיתוח תרופות באוניברסיטת ת"א, ובעזרת מימון מהרשות לחדשנות בתכנית קמין פיתחו החוקרים מולקולות חדשניות המעכבות באופן יעיל את פעילות ה- TRPV2. מעכבים אלו מפחיתים את יכולת הנדידה של המקרופאגים לכיוון גורמי דלקת ברקמה וטיפול בהם בימים הראשונים שלאחר האוטם גרם לעליה משמעותית בתפקוד הלב וירידה ברקמת הצלקת לעומת טיפול ביקורת (תמונה 2). במחקר נוסף, הראה צוות המעבדה שמעכבים אלו גם מאטים חלוקה ונדידה של תאי סרטן ועל כן הם עשויים לשמש גם כמעכבים ביישומים אונקולוגיים.
בהתאם לממצאים אלה הוקמה לאחרונה, חברת הזנק בשם Ionara Bio יחד עם חממת Incentive בהובלת ד"ר נילי שוץ. מטרת תכנית הפיתוח היא לשפר את המאפיינים של מולקולת המעכב המובילה שבידי המעבדה (ABP5-T11). כוונת החברה לפתח מולקולה שתינתן במהלך צנתור לבבי או בבליעה, למטופלים שעברו אוטם, במהלך השבוע הראשון אחרי האוטם. החברה משתפת פעולה עם יועצי כימיה רפואית וכימיה חישובית ומבצעת תהליכים בהם היא מנסים להגיע למולקולה סופית בשנה הקרובה. בהמשך, בכוונת החברה לפתח גם מולקולות לשימוש בטיפול האונקולוגי.
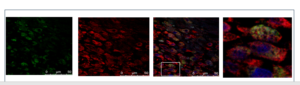
צביעה פלורוסנטית למקרופגים ולתעלת TRPV2 : צביעה פלואורוסנטית כפולה עם נוגדן למקרופאגים (צבע ירוק) ונוגדן לתעלת ה-TRPV2 (אדום) המדגימה שתעלה זו אכן מתבטאת ברמה גבוהה על המקרופאגים שנודדים לאזור האוטם בשלב הדלקת החריפה.
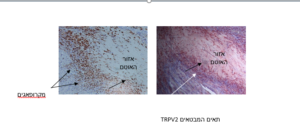
אימונוהיסטוכימיה לחתכי לב ביום 3 לאחר האוטם: צביעת חתכי לב לאחר אוטם בנוגדן למקרופאגים או בנוגדן ל-TRPV2. הצביעה מצביעה כי המקרופאגים והתאים מבטאי ה-TRPV2 מתמפים לאזור שמסביב לאוטם.
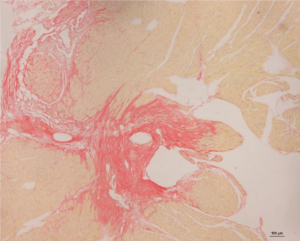
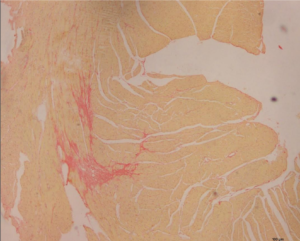
טיפול במעכב TRPV2 (ABP5-T11) מקטין משמעותית את גודל רקמת הצלקת הפיברוטית בלב
צביעת פיברוזיס (צילוק) לחתכי לב של עכברים שעברו אוטם לבבי חריף 30 יום קודם לכן וטופלו במעכב ה-TRPV2 (חתך ימני) לעומת ביקורת לא מטופלת (חתך שמאלי). החתכים מדגימים שיפור ניכר במבנה הלב בעקבות הטיפול.
דר' מיכל אנטין-מר ופרופ גד קרן